Amphibien und biologische Stechmückenbekämpfung
Einleitung
Aufgrund der mosaikartigen Verzahnung von Landlebensräumen und Reproduktionsgewässer stellen die dem direkten Rheinregime ausgesetzten Oberrheinauen für viele Amphibienarten einen idealen Lebensraum dar.
Die im Oberrheingraben häufigsten Amphibienarten sind Grasfrosch, Erdkröte und Wasserfrosch. Schwerpunktmäßige Vorkommen haben hier die Kreuzkröte und der Seefrosch. Der Moorfrosch erreicht hier die Westgrenze seines Verbreitungsgebiets. Darüber hinaus liegen Fundmeldungen eingeschleppter bzw. ausgesetzter Arten wie z.B. des Ochsenfroschs (Rana catesbeiana) in der Oberrheinebene vor.
Hinsichtlich der biologischen Stechmückenbekämpfung könnten grundsätzlich zwei Faktoren einen Einfluss auf die lokalen Amphibienpopulationen haben:
- direkte Toxizität des Bekämpfungswirkstoffs BTI (Bacillus thuringiensis israelensis)
- Auswirkungen auf das Nahrungsangebot
Dabei ist zwischen möglichen Auswirkungen auf die Adulten einerseits und die Amphibienlarven andererseits zu unterscheiden.

Untersuchungsergebnisse der KABS
Toxizität gegen Amphibienlarven
Einer möglichen Beeinträchtigung der Amphibien und besonders ihrer Larven durch die Anwendung von BTI ist die KABS von Beginn an nachgegangen. Bereits die Arbeitsgruppe „Rheinschnakenbekämpfung“ am Zoologischen Institut der Universität Heidelberg beschäftigte sich mit diesem Thema.
So untersuchte bereits Morawscik (1983) in seiner Dissertation die Wirkung von BTI auf 18 verschiedene wasserlebende Tiergruppen in Labor- und Freilandtests. Darunter waren Strudelwürmer, Muscheln, Schnecken, Krebstiere, diverse Insektenarten, Fische und Amphibienlarven (Bergmolch, Gelbbauchunke, Erd-, Wechsel- und Kreuzkröte sowie Wasser- und Grasfrosch). Darüber hinaus führte Morawscik (1983) auch Tests an Kaulquappen des afrikanischen Krallenfroschs (Xenopus laevis) durch. Dabei stellte er sowohl bei dieser Amphibienart als auch bei den Kaulquappen einheimischer Froschlurche eine deutliche Empfindlichkeit dieser Tierarten gegen die im Test verwendeten BTI-Produkte fest.
Aufgrund dieser Ergebnisse ging deshalb Prüfer (1983), welche derselben Arbeitsgruppe angehörte, in einer gesonderten Untersuchung diesen Beobachtungen nach. Dabei sollte geklärt werden:
- warum früher getestete BTI-Präparate toxisch auf Anuren-Larven wirkten,
- welches dabei das eigentliche toxische Agens sei,
- welcher Natur das Toxin sein könnte und
- wie und wo es wirkt.
Für die Versuche wurden Kaulquappen des Krallenfrosches Mortalitätstests unterworfen. Dabei kamen Konzentrationen der verwendeten BTI-Formulierungen von 1,8 mg/l bis 580 mg/l zur Anwendung.
Getestet wurden sechs Chargen von BTI-Präparaten, die im Auftrag der Autorin hergestellt wurden (Biologische Aktivität zwischen 1.000 und 4.000 ITU/mg) sowie die kommerziellen BTI-Präparate Teknar 402 (1.000 ITU/mg), Bactimos (6.000 ITU/mg) und ABG (1.000 ITU/mg).Darüber hinaus wurden die Internationalen Pasteur-Standards IPS 78 (1.000 ITU/mg) und IPS 80 (8.000 ITU/mg) getestet.
Die Mortalitätstests wurden an unterschiedlich alten Larven durchgeführt. Dabei wurden die Larven verschieden hohen Konzentrationen der genannten BTI-Präparate ausgesetzt. Die Bestimmung der Mortalität erfolgte nach 24 Stunden.
Ein weiterer Mortalitätstest wurde an drei Tage alten Larven durchgeführt. Dabei wurden diese Larven unterschiedlich langen Einwirkungszeiten einer BTI-Lösung von 180 mg/l ausgesetzt, bevor sie in Quellwasser weitergehältert wurden. Die Bestimmung der Mortalität erfolgte nach 24 Stunden.
Wichtigste Ergebnisse
Zunächst wurden Krallenfroschlarven unterschiedlicher Altersklassen verschiedenen Konzentrationen des BTI-Präparats BR 8102 (1.000 ITU/mg; Auftragsproduktion für das Testlabor) ausgesetzt.
Es stellte sich heraus, dass die Krallenfroschlarven sensibel auf die Anwendung des BTI-Präparats reagierten. Überraschend war, dass Larven in der ersten Woche nach dem Schlupf zunächst unempfindlich reagierten. Erst mit steigendem Alter nahm die Empfindlichkeit zu. Unabhängig von der Entwicklungsstufe starben die Larven jedoch, wenn die Konzentration des Präparats BR 8102 320 mg/l (entsprechend 320.000 ITU/l) erreichte.
Der Mortalitätstest an sehr jungen Larven erbrachte keine Sterblichkeit. Da sehr junge Larven von ihrem Dottervorrat leben und noch keine Nahrung aufnehmen, war bei dieser Altersklasse noch keine BTI-Wirkung zu verzeichnen. Als Umkehrschluss wurde festgestellt, dass das für die Mortalität verantwortliche Toxin also peroral von den Larven aufgenommen werden musste, damit es wirken konnte.
Eine toxische Wirkung trat aber nur dann ein, wenn die Kaulquappen über längere Zeiträume den BTI-Formulierungen ausgesetzt waren oder nach einer kurzen Expositionszeit, der eine Hälterung in klarem Wasser folgte. Konnten die Tiere nach zeitlich begrenzter Exposition weiter Nahrung aufnehmen, wurde keine erhöhte Mortalität beobachtet.
Die Mortalitätstests mit den verschiedenen BTI-Präparaten ergab bei einer Konzentration von jeweils 180 mg/l sehr unterschiedliche Ergebnisse (Tabelle 1):
Tabelle 1: Verhältnis von biologischer Aktivität der getesteten BTI-Formulierungen und Mortalität von X. laevis-Kaulquappen.
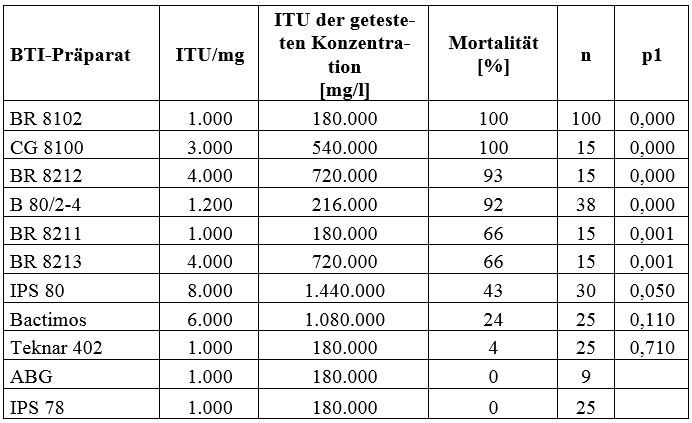
Aufgrund dieses äußerst heterogenen Bildes kommt die Autorin zu dem Schluss, dass nicht das BTI-Toxin selbst für die beobachtete toxische Wirkung verantwortlich sein kann, sondern ein Bestandteil der „inerten“ Zusatzstoffe, die variabler Bestandteil aller BTI-Formulierungen sind, dafür verantwortlich sein muss.
Um dieser Vermutung nachzugehen wurden BTI-Kulturen getestet, die von der Arbeitsgruppe „Rheinschnakenbekämpfung“ selbst herangezüchtet wurden. Dazu wurde der BTI-Stamm H14 A201 verwendet, der nach unterschiedlich langen Kulturzeiträumen (6, 9, 12, 15, 24 und 72 Stunden) „geerntet“ und in Konzentrationen von 18, 180, 320 und 580 mg/l getestet wurde.

Die Bestimmung der Xenopus-Mortalität nach 24 h zeigte, dass bei diesem Versuch nur sehr geringe Mortalitätsraten auftraten. Die reinen Bakterienkulturen erwiesen sich also als weitgehend nicht-toxisch für Xenopus-Larven. Da Tests gegen den Zielorganismus Aedes aegypti jedoch eine deutliche Wirkung belegten, folgerte Prüfer (1983), dass bei den Kulturen nachweislich eine Produktion des BTI-typischen δ-Endotoxins stattgefunden haben musste. Sie folgerte weiterhin, dass dieses δ-Endotoxin nicht ursächlich für die bei Xenopus beobachtete toxische Wirkung sein konnte!
In weiteren Versuchsansätzen versuchte die Autorin das toxische Agens zu charakterisieren. Auf diese Weise konnte eine mögliche Wirkung von Exotoxinen (Phospholipase-C, Hämolysin, Proteasen), die bei der Fermentation gebildet wurden, ausgeschlossen werden.
Letztendlich wurde für die Toxizität ein bislang unbekanntes Protein von BTI verantwortlich gemacht, welches 20-40 kDa groß und hitzelabil ist. Als wahrscheinlichen Wirkungsort gibt die Autorin das Darmsystem an, wo es unter alkalischen Bedingungen herausgelöst und resorbiert wird. Als möglichen Angriffspunkt des Toxins nennt die Autorin die roten Blutkörperchen, wodurch bei den Kaulquappen eine Atmungshemmung hervorgerufen wird.
Die Autorin vermutet, dass dieses unbekannte Toxin nur unter bestimmten Fermentationsbedingungen gebildet wird, weil es in industriell hergestellten Chargen enthalten ist, in den Laborkulturen hingegen nicht. Sie schließt damit, dass dieses Toxin in so geringen Mengen gebildet wird, dass seine Wirkung bei der praktischen Anwendung vernachlässigt werden kann, da eine Wirkung gegen Kaulquappen erst ab einer gegenüber dem Feldeinsatz dreifach erhöhten Aufwandmenge zu erwarten sei.
Da die mögliche Wirkung von BTI auf Amphibienlarven insbesondere von Naturschutzverbänden als Kritikpunkt gegen die Biologische Stechmückenbekämpfung am Oberrhein immer wieder thematisiert wurde, erfolgte von 1990 bis 1991 an der Universität Mainz erneut eine wissenschaftliche Untersuchung dieses Sachverhalts.
In ihrer Diplomarbeit testete Scholten (1991) nochmals die Wirkung von BTI-Präparaten auf Embryonen und Larven (Kaulquappen) von Kreuzkröte (Bufo calamit ) und Krallenfrosch (Xenopus laevis). Die Auswirkungen wurden dabei über einen Zeitraum von 28 Tagen über die Metamorphose hinaus beobachtet.
Getestet wurden die kommerziellen BTI-Formulierungen Bactimos (Puderformulierung, 10.000 ITU/mg) und Teknar HP-D (Flüssigformulierung, 1.200 ITU/mg).
Testreihe an Embryonen (befruchtete Eier)
Der zeitliche Ablauf der Embryonalentwicklung unter dem Einfluss verschiedener BTI-Konzentrationen wurde mit Hilfe von Normentafeln nach Gossner bzw. Nieuwkoop & Faber beurteilt.
Testreihen an Larven
Die Untersuchungen wurden in zwei verschiedenen Jahren durchgeführt. In der Versuchsserie 1989 wurden die BTI-Konzentrationen so gewählt, dass alle möglichen bei der Stechmückenbekämpfung im Freiland auftretenden Konzentrationen getestet wurden (0,1, 0,2, 0,5, 1, 3, 10 und 100 mg/l) wobei letztere als starke Überdosierung gewertet wurde. Dieser Versuch wurde mit jeweils 20 Versuchstieren (B. calamita) in belüfteten 15 l-Aquarien durchgeführt.
Da sich die beiden BTI-Formulierungen sehr stark in ihrer biologische Aktivität, also der tatsächlich im Produkt enthaltenen Menge an BTI-typischem δ-Endotoxin, unterschieden, waren die bei den Versuchen eingesetzten BTI-Konzentrationen sehr unterschiedlich. Die Beziehungen zwischen eingesetzten Produkt-Konzentrationen und der biologischen Aktivität ist in Tabelle 2 dargestellt.
Tabelle 2: Beziehung von verwendetem Produkt, eingesetzter Konzentration und biologischer Aktivität.
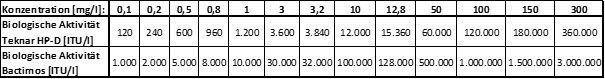
In der Versuchsserie 1990 wurden toxikologische Dauertests angesetzt. Dabei wurden jeweils 25 Versuchstiere (B. calamita bzw. X. laevis) in belüfteten 15 l-Aquarien während ihrer gesamten Entwicklungszeit den Testkonzentrationen ausgesetzt. Diese Testreihe diente dazu mit Hilfe statistischer Auswertungen die BTI-Konzentration zu ermitteln, bei der sich an den Versuchstieren noch keine signifikanten Unterschiede zur Kontrolle zeigten (NOEC).
Da sich bereits zu Beginn der Versuchsserie zeigte, dass die unter den Feldbedingungen der Stechmückenbekämpfung eingesetzten BTI-Konzentrationen zur Bestimmung der NOEC zu niedrig lagen, mussten höhere Testkonzentrationen eingesetzt werden. Diese lagen bei 0,2, 0,8, 3,2, 12,8, 50, 150 und 300 mg/l.
Die Entwicklung und Größe der Larven wurde durch wöchentliche Messungen bzw. anhand der Normentafeln nach Gossner bzw. Nieuwkoop & Faber ermittelt.
Wichtigste Ergebnisse
BTI-Wirkung auf die Embryonalentwicklung
Bei keiner Versuchstierart konnte eine Entwicklungsverzögerung festgestellt werden. Die Schlüpfrate aus dem Ei lag bei allen Versuchen bei 100%. D.h. eine Auswirkung der BTI-Präparate auf die Embryonalentwicklung fand nicht statt.
BTI-Wirkung auf die Larvalentwicklung
Die Ergebnisse der Tests, die unter Verwendung relativ niedriger BTI-Konzentrationen durchgeführt wurden, zeigen ein recht heterogenes Bild. So konnte z.B. bei B. calamita eine signifikant schnellere Entwicklung unter Einfluss der hohen BTI-Konzentrationen (10 bzw. 100 mg/l) beobachtet werden.
Die Ergebnisse der toxikologischen Dauertests zeigen bei B. calamita nur am Anfang der Entwicklung einige Unterschiede in Abhängigkeit von den BTI-Konzentrationen, am Ende wurden die Entwicklungsunterschiede wieder ausgeglichen.
Bei X. laevis entwickelten sich die Larven bei den hohen Konzentrationen signifikant langsamer. Nach zwei Wochen war dieser Unterschied jedoch wieder aufgeholt. Diese Tiere waren bei Versuchsende sogar signifikant Größer als die in den niedrigeren Konzentrationen. Mit einem maximalen Zeitunterschied von 48 h schlossen alle Larven die Metamorphose ab.
Generell wurde festgehalten, dass die Entwicklung beider Versuchstierarten unter dem Einfluss von Bactimos (BTI-Puderformulierung, hohe biologische Aktivität) gleichmäßiger verläuft und am Ende kaum Unterschiede zur Kontrolle festzustellen sind. Diese sind unter dem Einfluss von Teknar HP-D (BTI-Flüssigformulierung, niedrige biologische Aktivität) und insbesondere bei X. laevis viel deutlicher.
Über eine Mortalität der Larven, die im direkten Verlauf der Versuchsreihen auftritt, berichtet die Autorin nichts. Dies ist insofern bemerkenswert, da in den Versuchsreihen BTI-Konzentrationen auftreten, die z.T. ein Vielfaches der Konzentrationen betrugen, bei denen Prüfer (1983) bereits hohe Mortalitätsraten verzeichnete!
Beobachtung nach der Metamorphose
Bei allen Versuchsreihen des Jahres 1989 konnte nach der Metamorphose bei B. calamita eine gewisse Mortalität festgestellt werden. Diese war aber offensichtlich unabhängig von den verwendeten BTI-Konzentrationen und trat in unterschiedlichem Ausmaß (bis zu 30%) auch in den Kontrollen auf. Auch bezüglich der verwendeten Formulierung ergab sich kein einheitliches Bild. Die Autorin schließt nicht aus, dass die Haltungsbedingungen nach der Metamorphose einen Einfluss auf die Mortalität hatten. So überlebten nach Änderung der Haltungsbedingungen nach den Versuchen des Jahres 1990 100% der Versuchstiere.
Anders bei X. laevis: hier konnte bei Verwendung der BTI-Formulierung Bactimos, also unter dem Einfluss eines hohen BTI-Anteils, keinerlei Beeinträchtigung festgestellt werden. Alle Tiere entwickelten sich ohne Störungen im Körperbau oder Verhalten. Unter dem Einfluss der Flüssigformulierung Teknar HP-D jedoch erreichten die Larven der einen Versuchsreihe innerhalb dreieinhalb Monaten nicht einmal die Metamorphose. Bei der zweiten Versuchsreihe entwickeln sich die Tiere sehr unterschiedlich und wiesen nach der Metamorphose teilweise Missbildungen auf.
In der abschließenden Diskussion legt die Autorin dar, dass sich X. laevis offenbar grundsätzlich nicht gut als Versuchstier für diese Untersuchung eignet. Nach ihren Angaben entwickelten sich nicht verwendete Versuchstiere in ihren Hälterungsbecken prinzipiell deutlich schneller und besser als die Tiere in den Versuchsansätzen (auch der Kontrolle!). Sie führt das darauf zurück, dass in den Versuchsansätzen aus methodischen Gründen keine hohen Wasserwechselintervalle eingehalten werden konnten. Diese sind aber notwendig um Crowding-Effekte (Wachstumshemmung durch ins Wasser abgegebene Substanzen) zu unterdrücken.
Die Anwendung von BTI in Konzentrationen, die der Aufwandmenge für den Feldeinsatz der Stechmückenbekämpfung entsprechen, sieht die Autorin als unproblematisch an.
Vor diesem Hintergrund erscheint es als sicher, dass es durch die Anwendung von BTI selbst zu keinen Auswirkungen auf Amphibienlarven durch die direkte Toxizität des δ-Endotoxin kommt.
Die Autoren einer Studie an Kaulquappen südamerikanischer Braunfrösche (Lajmanowich et al. 2015) kommen zwar zu einer gegenteiligen Beurteilung, diese Studie ist jedoch mit Fehlern behaftet (u.a. ist die Herkunft der einzigen getesteten BTI-Formulierung völlig unklar!). Sehr wahrscheinlich sind die beobachteten Wirkungen auch hier auf toxisch wirkende Zusatzstoffe der verwendeten Flüssigformulierung zurückzuführen und nicht auf den BTI-Wirkstoff selbst.
Darüber hinaus weisen wir darauf hin, dass der von Lajmanowich et al. (2015) im Bioassay bestimmte Wert für die direkte Toxizität an Kaulquappen der 112fachen Konzentration des von der KABS im Feldeinsatz ausgebrachten Bekämpfungsstoffs beträgt!
Auswirkungen auf die Amphibiennahrung
Nach den Untersuchungen zur Toxizität von BTI gegen Amphibienlarven widmete sich die KABS dem Aspekt der potentiellen Auswirkungen, die die biologische Stechmückenbekämpfung auf die adulten Amphibien haben könnte.
Im Rahmen verschiedener nahrungsökologischer Studien untersuchte daher Blum (1994, 1995, 1996, 1998) die Nahrungszusammensetzung von sechs Amphibienarten der Oberrheinauen. Dabei sollten die Fragen geklärt werden, inwieweit adulte Amphibien eine natürliche Alternative zur Reduzierung der Stechmücken darstellen und ob sich die Stechmückenbekämpfung negativ auf die Ernährung von Froschlurchen auswirken könnte.
Im Vordergrund standen folgende Aspekte:
1. der Einfluss der Jahreszeiten auf das Beutespektrum,
2. Unterschiede im Nahrungsspektrum der verschiedenen Altersklassen,
3. das Nahrungsspektrum in verschiedenen Biotoptypen
4. sowie die Größenverhältnisse der Beutetiere.
Zum qualitativen Vergleich von mit B.t.i. (Bacillus thuringiensis israelensis) behandelten und unbehandelten Gebieten wurden die Hördter Rheinaue (mit Stechmückenbekämpfung) und der Altrhein Wörth (ohne Stechmückenbekämpfung) ausgewählt. Dort wurden jeweils sechs Amphibienarten und ein Artenkomplex untersucht: Knoblauchkröte (Pelobates fuscus), Erdkröte (Bufo bufo), Laubfrosch (Hyla arborea), Moorfrosch (Rana arvalis), Springfrosch (Rana dalmatina), Grasfrosch (Rana temporaria) und der Wasserfrosch-Komplex (Rana kl. esculenta).

Wichtigste Ergebnisse
Der Mageninhalt von 2.700 Exemplaren aus der Gruppe Anura wurde untersucht und dabei 20.525 Beuteindividuen nachgewiesen. Die Beutespektren der untersuchten Amphibienarten wurden durch die saisonal und lokal schwankende Nahrungsverfügbarkeit beeinflusst. Insgesamt war ein breites Beutespektrum festzustellen, das keine Hinweise auf eine nahrungsökologische Spezialisierung erkennen ließ. Lediglich die Erdkröte wies ein engeres Nahrungsspektrum auf, in dem vor allem Ameisen und Käfer dominierten.
Bezüglich der Beutetiergröße konnte eine aktive Beutewahl festgestellt werden. Die meisten Beutetiere waren > 5 mm groß. Zwischen den in den jeweiligen Lebensräumen vorkommenden potenziellen Beutetieren und den tatsächlich in den Mägen der Amphibien nachgewiesenen Beutetieren bestand keine deutliche Korrelation. Auch zwischen der Größe und Gewicht der Amphibien und Größe und Gewicht der Beutetiere konnte kein signifikanter Zusammenhang nachgewiesen werden.
Bezüglich der Stechmücken im Nahrungsspektrum wurde festgestellt, dass es sich von den 20.525 identifizierten Beutetieren dieser Untersuchung nur bei 29 Individuen (0,14%) um Stechmücken handelte (Tabelle 3). Im unbehandelten Gebiet „Altrhein Wörth“ lag dabei der Gesamtanteil der Stechmücken in der Anuren-Nahrung bei 0,09%, im Gebiet mit Stechmückenbekämpfung sogar bei 0,15%.
Tabelle 3: Anteil der Stechmücken in der Nahrung von Anuren (nach BLUM 1998).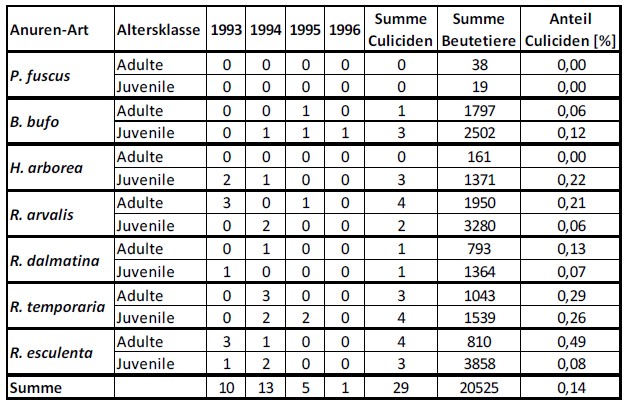
Mit Ausnahme der Knoblauchkröte konnten einzelne Stechmücken in den Nahrungsspektren aller untersuchten Anuren-Arten festgestellt werden, dabei blieben die jeweiligen Anteile sowohl bei ausgewachsenen als auch juvenilen Anuren stets weit unter einem Prozent.
Als Fazit konstatiert der Autor, dass die biologische Stechmückenbekämpfung keine direkten negativen Auswirkungen auf die Ernährung der Froschlurche zeigte, die daher selbst wiederum für die natürliche Bekämpfung der Stechmücken keine Bedeutung besitzen.
Betrachtungen zu Amphibienarten des Anhangs II der FFH-Richtlinie
Diese von der KABS durchgeführten Studien belegen die Unbedenklichkeit der BTI-Anwendung auf Amphibien. Dennoch soll an dieser Stelle dieses Konfliktfeld bezüglich der beiden Amphibienarten, die in Anhang II der FFH-Richtlinie Richtlinie 92/43/EWG gelistet sind, und die in den Rheinauegebieten auftreten können, Gelbbauchunke (Bombina variegata) und Kammmolch (Triturus cristatus), kritisch betrachtet werden.
Einer von mehreren Verbreitungsschwerpunkten der Gelbbauchunke in Baden-Württemberg ist die Oberrheinebene, wo sie bevorzugt die Rheinauewälder besiedelt aber auch in den Hardtwäldern vorkommt. Während sie in manchen Auegebieten weit verbreitet ist (Weisweil, Rheinau, Rastatt) fehlt sie z.B. zwischen Karlsruhe und Mannheim fast völlig (Genthner & Hölzinger 2007).
Die Gelbbauchunke ist auf charakteristische Bruthabitate spezialisiert. Sie bevorzugt insbesondere flache Kleingewässer in frühen Sukzessionsstadien mit ausreichender Besonnung. Die Mindestwasserführung für eine erfolgreiche Reproduktion beträgt etwa 45 Tage (Dieterich 2002). Damit unterscheiden sich die Laichgewässer der Gelbbauchunke deutlich von den typischen Brutgewässern der Überschwemmungsmücken in den Rheinauen. Diese weisen in der Regel eine wesentlich kürzere Wasserführung auf und sind oft stark von Vegetation bedeckt. Aufgrund dieser unterschiedlichen Habitatpräferenzen ist es weitgehend auszuschließen, das Kaulquappen der Gelbbauchunke durch eine BTI-Applikation getroffen werden könnten. Zumal eine BTI-Applikation in der frühen Phase der Überflutung erfolgt während die Kaulquappen erst deutlich später, nach dem Ablaichen und dem Abschluss der Embryonalentwicklung, im Gewässer auftreten.
Druckwasserflächen auf Äckern, die nach Genthner & Hölzinger (2007) in Flussauen ein Laichhabitat für Gelbbauchunken darstellen, sind in der Regel keine Brutstätten der Überschwemmungsmücken und werden daher von einer Bekämpfung ohnehin ausgenommen.
Die Nahrung der Kaulquappen besteht aus Algenaufwuchs, Resten toter Tiere und Pflanzen und organischen Partikeln (Genthner & Hölzinger 2007) somit besteht keine Gefahr, dass es durch die biologische Stechmückenbekämpfung zu einer Einschränkung der Larvennahrung kommen könnte.
Ein Verbreitungsschwerpunkt des Kammmolchs in Baden-Württemberg ist das Oberrheintal wo man ihn hauptsächlich im Auwald und in Kiesgruben antrifft. So finden sich in den Rheinauen zwischen Rastatt und Mannheim große Bestände dieser Tierart (Rimpp 2007).
Der aquatische Lebensraum umfasst alle Typen stehender Gewässer, lediglich Kleinstgewässer sowie Fließgewässer und langsam fließende Entwässerungsgräben werden gemieden. Ideal sind größere, mindestens 70 cm tiefe und fischfreie Gewässer mit reicher Unterwasservegetation (Rimpp 2007). Nach Stoll (2002) bevorzugt der Kammmolch Gewässer, die nicht oder nur sehr selten überflutet werden. Wie schon bei der Gelbbauchunke beschrieben unterscheidet sich auch hier wieder der bevorzugte Typ des Laichgewässers grundsätzlich von den nur kurzzeitig auftretenden Brutgewässern der Überschwemmungsmücken. Aufgrund dieser unterschiedlichen Habitatpräferenzen ist es auch hier wieder weitgehend auszuschließen, das Larven und Adulte des Kammmolchs durch eine BTI-Applikation getroffen werden könnten.

Vom Kammmolch ist bekannt, dass er sich sowohl als Adulttier wie auch als Larve von Stechmückenlarven ernähren kann. Ungeachtet der unterschiedlichen Habitatpräferenz könnte diese Tierart also prinzipiell durch die Reduktion des Nahrungsangebots durch die biologische Stechmückenbekämpfung betroffen werden.
Dass Kammmolche effektive Fressfeinde von Stechmückenlarven sind konnten schon Rieder et al. (1982) belegen. Dies gilt vor allem für die Larven. Das aquatische Nahrungsspektrum der Adulten variiert jahreszeitlich stark und umfasst Wasserasseln, Wasserschnecken, Larven und Puppen aller Arten von Insekten (z.B. Klein- und Großlibellen, Zuck- und Stechmücken, Waffen-, Köcher- und Eintagsfliegen, Wasserkäfer und Wasserwanzen). Gerade während der Laichzeit dienen ihnen jedoch Muschelkrebse, Hüpferlinge und Wasserflöhe als optimale Nahrungsquelle (Rimpp 2007).
Als Beleg, dass die biologische Stechmückenbekämpfung die Population des Kammmolches in den Rheinauen nicht beeinträchtigt, sollen hier zwei reale Beispiele genannt werden:
In den regelmäßig bekämpften Stechmückenbruthabitaten Mannheims konnten im Jahr 2012 an der Population des Kammmolchs gegenüber einer 25 Jahre zurückliegenden Studie keine Veränderungen festgestellt werden (Neugebauer & Wenning 2012).
Als zweites Beispiel sei auf das Natura 2000-Gebiet 7015-341 (Rheinniederung zwischen Wintersdorf und Karlsruhe) hingewiesen. Dort hat sich in regelmäßig bekämpften Rhein- und Waldschnakenflächen bei Rheinstetten-Mörsch die Population des Kammmolches in den zurückliegenden Jahren sogar so stark entwickelt, dass die Naturschutzbehörde von dort Tiere abfängt, um mit ihnen im Rahmen des LIFE+ -Projekts „Rheinauen bei Rastatt“ neu angelegte Amphibiengewässer zu besiedeln (http://www.rheinauen-rastatt.de/)!
Fazit
Nach fast 40 Jahren biologischer Stechmückenbekämpfung in den Oberrheinauen gibt es nicht einen belegten Fall, dass es durch den BTI-Einsatz zu einer Schädigung der lokalen Amphibienpopulationen gekommen sei. Es ist vielmehr so, dass es in regelmäßig Bekämpften Rheinauegebieten in den vergangenen Jahren zu einer Zunahme der Individuenzahlen kam. Neben den oben erwähnten Beispielen für den Kammmolch soll hier z.B. auf den Laubfrosch verwiesen werden, dessen Population im Oberrheingebiet in den zurückliegenden Jahren deutlich zugenommen hat und sich weiter ausbreitet. So können von dieser im Stadtkreis Mannheim einst verschollenen Amphibienart mittlerweile kopfstarke Chöre in den Stechmückenbrutstätten des Stadtgebiets beobachtet werden (Neugebauer & Wenning 2012).
Diese Beispiele zeigen, dass für den landes- wie auch bundesweit zu beobachtenden Rückgang der Amphibienpopulationen andere Faktoren ausschlaggebend sind, als die biologische Stechmückenbekämpfung. Entscheidender sind hier der Lebensraumverlust durch Trockenlegung (Sowig 2007), die Lebensraumzerschneidung durch Verkehrswege (Laufer & Zurmöhle 2007), amphibienschädigende Methoden in Land- und Forstwirtschaft (Fritz 2007, Oppermann 2007) sowie die Fischereiwirtschaft (Bauer & Laufer 2007) und Gewässerversauerung (Gebhardt 2007), um nur einige zu nennen.
Vor dem dargestellten Hintergrund können keine Anzeichen dafür gefunden werden, dass die biologische Stechmückenbekämpfung die lokalen Amphibienpopulationen negativ beeinflussen würde.
Eine Erheblichkeit der biologischen Stechmückenbekämpfung im Sinne von Artikel 6, Absatz 3 der FFH-Richtlinie 92/43/EWG kann somit bezüglich der Amphibien nicht festgestellt werden.
Zitierte Literatur
Bauer, S. & Laufer, H. (2007): Fische, Fischerei und Amphibien. - In: Laufer, H. Fritz, U. & Sowig, P. (Hrsg.) (2007): Die Amphibien und Reptilien Baden-Württembergs; Ulmer-Verlag, S. 135-143.
Blum, S. (1994): Endbericht 1994: Untersuchungen zur Nahrungsökologie von Auenamphibien im Zusammenhang mit der biologischen Stechmückenbekämpfung; KABS-Bericht. (Zusammenfassung)
Blum, S. (1995): Untersuchungen zum Nahrungsspektrum von Amphibien im Jahr 1993 in den rheinland-pfälzischen Rheinauen im Zusammenhang mit der biologischen Stechmückenbekämpfung; Diplomarbeit.(Zusammenfassung)
Blum, S. (1996): Abschlussbericht 1996: Untersuchungen zum Beutespektrum von Auenamphibien in der Hördter Rheinaue und im Altrhein Wörth 1993-1996; KABS-Bericht. (Zusammenfassung)
Blum, S. (1998): Untersuchungen zur Nahrungsökologie von Froschlurchen (Amphibia, Anura) der rheinland-pfälzischen Rheinaue im Hinblick auf die Bekämpfung der Stechmücken (Diptera, Culicidae); Dissertation. (Zusammenfassung)
Fritz, C. (2007): Wald und Forstwirtschaft. - In: Laufer, H. Fritz, U. & Sowig, P. (Hrsg.) (2007): Die Amphibien und Reptilien Baden-Württembergs; Ulmer-Verlag, S. 112-124.
Gebhardt, H. (2007): Gewässerversauerung und Amphibien. - In: Laufer, H. Fritz, U. & Sowig, P. (Hrsg.) (2007): Die Amphibien und Reptilien Baden-Württembergs; Ulmer-Verlag, S. 124-131.
Genthner, H. & Hölzinger, J. (2007): Gelbbauchunke Bombina variegata (Linnaeus, 1758). - In: Laufer, H. Fritz, U. & Sowig, P. (Hrsg.) (2007): Die Amphibien und Reptilien Baden-Württembergs; Ulmer-Verlag, S. 271-292.
Lajmanowich, R.C., Junges, C. M., Cabagna-Zenklusen, M. C., Attademo, A. M., Peltzer, P. M., Maglianese, M., Márquez, V. E. & Beccaria, A. J. (2015): Toxicity of Bacillus thuringiensis var. israelensis in aqueous suspension on the South American common frog Leptodactylus latrans (Anura: Leptodactylidae) tadpoles. - Environmental Research 136: 205-212.
Laufer, H. & Zurmöhle, H.-J. (2007): Dauerhafte Amphibienschutzmaßnahmen an Straßen. - In: Laufer, H. Fritz, U. & Sowig, P. (Hrsg.) (2007): Die Amphibien und Reptilien Baden-Württembergs; Ulmer-Verlag, S. 143-157.
Morawcsik, J. (1983): Untersuchungen zur Wirkung von Bacillus thuringiensis var. israelensis auf aquatische Nontarget-Organismen; Dissertation Universität Heidelberg. (Zusammenfassung)
Neugebauer, H. & Wenning, J. (2012): Amphibienkartierung im Stadtkreis Mannheim. - Projektbericht für die Stadt Mannheim; 240 pp.
Oppermann, R. (2007): Auswirkungen landwirtschaftlicher Mähgeräte auf Amphibien. - In: Laufer, H. Fritz, U. & Sowig, P. (Hrsg.) (2007): Die Amphibien und Reptilien Baden-Württembergs; Ulmer-Verlag, S. 102-108.
Prüfer, B. (1983): Untersuchungen zur Charakterisierung der toxischen Wirkung von Bacillus thuringiensis var. israelensis-Präparaten auf Xenopus laevis-Larven; Diplomarbeit Universität Heidelberg. (Zusammenfassung)
Rimpp, K. (2007): Nördlicher Kammmolch Triturus cristatus (Laurenti, 1768). - In: Laufer, H. Fritz, U. &
Sowig, P. (Hrsg.) (2007): Die Amphibien und Reptilien Baden-Württembergs; Ulmer-Verlag, S. 207-222.
Rieder, N., Köhler, L. & Ott, H. (1982): Rheinschnakenbekämpfung in der Oberrheinebene. Über die Möglichkeit der Schnakenbekämpfung durch Amphibien, besonders durch Molche. - Veröff. Naturschutz und Landschaftspflege Bad.-Württ., 55/56: 405-413.
Scholten, F. (1991): Die Wirkung von Bacillus thuringiensis var. israelensis auf die Embryonal- und Larvalentwicklung ausgewählter Vertreter der einheimischen Anuren und Xenopus laevis; Diplomarbeit Universität Mainz. (Zusammenfassung)
Sowig, P. (2007a): Die Herpetofauna Baden-Württembergs. - In: Laufer, H. Fritz, U. & Sowig, P. (Hrsg.) (2007): Die Amphibien und Reptilien Baden-Württembergs; Ulmer-Verlag, S. 34-40.
Sowig, P. (2007b): Amphibien und Reptilien in der Agrarlandschaft. - In: Laufer, H. Fritz, U. & Sowig, P. (Hrsg.) (2007): Die Amphibien und Reptilien Baden-Württembergs; Ulmer-Verlag, S. 92-102.
Stoll, A. (2002): Vergleich zur Ökologie und Biologie von Molchpopulationen in rezenten und subrezenten Auebereichen des mittleren Oberrheins. - Diplomarbeit Universität Saarbrücken.


